Fatima Santos,Marlen Delgado
Reaccion de oxidación y reducción
¿Qué es una reacción redox?
Las reacciones de oxidación y reducción,
también denominadas redox, son las reacciones químicas en las que se produce
una transferencia de electrones entre los reactivos.
Estas reacciones reacciones están presentes en
diversas situaciones cotidianas, por ejemplo, en el funcionamiento de una serie
de productos de uso cotidiano, como una batería de automóvil o las pilas de una
linterna, o en fenómenos de la naturaleza, como la corrosión de un trozo de
hierro por la humedad ambiental o la oxidación de una manzana al ser expuesta
al aire.
Las reacciones de oxidación y
reducción son aquellas en las que se produce una transferencia de
electrones.
- La oxidación. Es un proceso
mediante el cual un átomo, un ion o una molécula ceden uno o más electrones. Si
el elemento pierde electrones, habrá aumentado su número de oxidación.
- La reducción. Es el proceso mediante el cual un átomo, un
ion o una molécula ganan electrones. En consecuencia, su número de oxidación
disminuye.
Estas reacciones se producen simultáneamente en dos
semireacciones: la semireacción de oxidación y la semireacción de
reducción.
Por ejemplo, al introducir una lámina de cobre (Cu)
en una disolución concentrada de nitrato de plata (AgNO3), es
posible notar al pasar unos minutos que la lámina de cobre empieza a recubrirse
de una capa de color grisácea, y que la disolución comienza a tonarse de color
celeste.
La ecuación química que representa este proceso es:
Cu(s) +
2AgNO3(ac) → Cu(NO3)2(ac)
+ 2Ag(s)
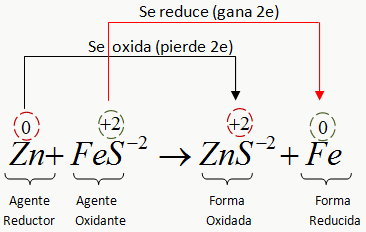
Agente oxidante y agente reductor
A las sustancias que ceden electrones se les llama agente
reductor, y a las que los captan, agente oxidante.
En toda reacción
redox, el agente reductor será aquel que cede electrones o se oxida, provocando
una reducción de la otra especie.
En toda reacción
redox llamaremos agente oxidante a aquel que se reduce o es capaz de captar
electrones, lo que provoca una oxidación de la otra especie
¿Qué son los números de oxidación?
Los químicos usan los números de oxidación (o estados de oxidación) para
saber cuándo electrones tiene un átomo. Los números de oxidación no siempre
corresponden a las cargas reales de las moléculas, pero podemos calcular los
números de oxidación de los átomos que están involucrados en un enlace
covalente (así como iónico).


No hay comentarios.:
Publicar un comentario